Elektrofilu pievienošana organiskajā ķīmijā
Piestiprināšanas reakcijas raksturojas arviens ķīmiskais savienojums no diviem vai vairākiem izejmateriāliem. Apsveriet, ka elektrolīzes piedevas mehānisms ir ērts alkēnu - nepiesātinātu aciklisko ogļūdeņražu ar vienu divkāršo saiti gadījumā. Neatkarīgi no tiem, pārējie ogļūdeņraži ar vairākām saitēm, ieskaitot cikliskus, iekļūst šādās transformācijās.
Sākotnējo molekulu mijiedarbības posmi
Elektrofīlo savienojumu notiek vairākāsposmos. Elektrofilu, kuram ir pozitīvs uzlādes līmenis, darbojas kā elektronu akceptors, un alkēna molekulas dubultsaite spēlē elektronu donoru lomu. Abi savienojumi vispirms veido nestabilu p-kompleksu. Tad sākas π-kompleksa pārveidošana ϭ-kompleksā. Karbokācijas veidošanās šajā posmā un tās stabilitāte nosaka mijiedarbības ātrumu kopumā. Pēc tam karbokācija ātri mijiedarbojas ar daļēji negatīvi slodzes nukleofilu, un tiek veidots gala transformācijas produkts.

Aizvietotāju ietekme uz reakcijas ātrumu
Uzlādēšanas (ϭ +) novirzīšana no jaunano sākotnējās molekulas struktūras. Pozitīvs induktīvs efekts, ko izraisa alkilgrupa, noved pie zemāka oglekļa atoma piesātinājuma. Rezultātā molekulā ar elektronu ziedojošo aizvietotāju palielinās katjona relatīvā stabilitāte, π-saites elektroniskais blīvums un molekulas reaktivitāte kopumā. Elektronu akceptoru reakcija uz reaktivitāti būs pretēja.
Halogēnu pievienošanas mehānisms
Sīkāk analizēsim elektrolīzes piedevas reakcijas mehānismu, piemēru, alkēna un halogēna mijiedarbībai.
- Halogēna molekula tuvojas divkāršai saiteistarp oglekļa atomiem un ir polarizēts. Sakarā ar daļēji pozitīvu uzlādi vienā molekulas galā, halogēns atvelk π-savienojumu elektronus. Tādā veidā veidojas nestabils π-komplekss.
- Nākamajā solī, lai izveidotu ciklu, elektrofilās daļiņas apvieno ar diviem oglekļa atomiem. Parādās ciklisks "onijs" jons.
- Atlikušā uzlādētā halogēna daļiņa(pozitīvi uzlādēts nukleofils) mijiedarbojas ar onija jonu un ir savienots ar iepriekšējās halogēna daļiņas pretējo pusi. Tiek parādīts gala produkts, trans-1,2-dihalogenalkāns. Tāpat arī halogēna pievienošana cikloalkenam.
Hidrohalogen skābju pievienošanas mehānisms

Elektrofilu pievienošanas reakcijasŪdeņraža halogenīdi un sērskābe darbojas citādi. Skābā vidē reaģents dissociē katijonā un anjonu. Pozitīvi lādēts jons (elektrofīls) uzliek π-saiti, apvieno ar vienu no oglekļa atomiem. Karbokāžas formas, kurās blakus esošais oglekļa atoms ir uzlādēts pozitīvi. Turklāt carbokācija reaģē ar anjonu, veidojot galīgo reakcijas produktu.
Reakcijas virziens starp asimetriskiem reaģentiem un Markovņikova likumu
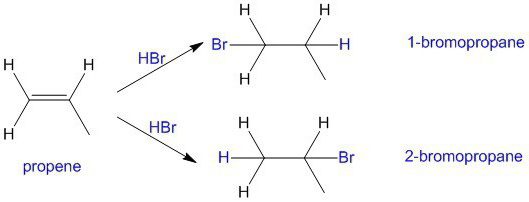
Elektrofilais stiprinājums starp diviemAsimetriskās molekulas darbojas regioselectively. Tas nozīmē, ka ir izveidots tikai viens no diviem iespējamiem izomēriem. Regioselectivitāte apraksta Markovņikova likumu, saskaņā ar kuru ūdeņradis ir saistīts ar oglekļa atomu, kas savienots ar lielu skaitu citu ūdeņraža atomu (vairāk hidrogenēta).
Lai saprastu šī noteikuma būtību, mums ir jāatceraska reakcijas ātrums ir atkarīgs no starpprodukta karbokācijas stabilitātes. Elektronu donoru un akceptora aizvietotāju ietekme tika apspriesta iepriekš. Tādējādi hidrobromīda skābes elektrofiliska pievienošana propēnam izraisa 2-brompropana veidošanos. Starpposma katija ar pozitīvu lādiņu uz centrālā oglekļa atoma ir daudz stabila nekā karboksīds ar pozitīvu lādiņu pie galējā atoma. Tā rezultātā broma atoms mijiedarbojas ar otro oglekļa atomu.

Elektronu izņemošā aizvietotāja ietekme uz mijiedarbības gaitu
Ja avota molekula saturelektronu atdalošais aizvietotājs ar negatīvu induktīvo un / vai mesomerisko efektu, elektrofilais stiprinājums ir pretrunā ar iepriekš aprakstīto noteikumu. Šādu aizvietotāju piemēri ir CF3, COOH, CN. Šajā gadījumā lielais attālums no pozitīvā lādiņa no elektronu izņemšanas grupas padara primāro carbocītu stabilāku. Tā rezultātā ūdeņradis apvienojas ar mazāk hidrogenētu oglekļa atomu.
Noteikuma universālais variants izskatīsies šādi: ja asimetriskā alkēna un asimetriskā reaģents mijiedarbojas, reakcija turpinās pa vis stabilitātes karbokācijas veidošanās ceļu.













